| [2010-019787-36] Ondansétron oral versus dompéridone pour la gastro-entérite aiguë dans les services d’urgence pédiatriques: essai contrôlé randomisé multicentrique en double aveugle.
Marchetti F, Bonati M, Maestro A, Zanon D, Rovere F, Arrighini A, et al. Source : PLOS ONE | https://doi.org/10.1371/journal.pone.0165441 Télécharger “Table 2010-019787-36-sondo” 2010-019787-36-sondo.zip – Téléchargé 3 fois – 1,30 Mo Droit d’auteur : Utilisation des données du rapport sans restriction pourvu que l’auteur original et la source soient cités (données brutes libres de droits). |
| Sommaire |
| Méthodes |
| Objectif :
Le but de l’étude est d’évaluer si une dose orale unique d’ondansétron par rapport à la dompéridone ou un placebo améliore les résultats chez les enfants atteints de gastro-entérite. Evaluation : Un essai contrôlé randomisé prospectif, multicentrique et en double aveugle impliquant des enfants admis dans 15 services d’urgence pédiatriques (SU) en Italie a été réalisé entre le 7 juillet 2011 (première randomisation) et le 3 novembre 2013 (dernier suivi). Dans cette étude, 356 enfants ont été randomisés pour recevoir une dose orale d’ondansétron (0,15 mg / kg), de dompéridone (0,5 mg / kg) ou un placebo. Le critère de jugement principal est le pourcentage d’enfants recevant une réhydratation nasogastrique ou intraveineuse après un échec symptomatique du traitement oral, défini comme des vomissements ou un refus hydrique après la deuxième tentative d’ORT. Les critères de jugement secondaires sont : – Le pourcentage de sujets restant au service d’urgence pour un séjour d’observation de plus de 6 heures ; – Le pourcentage de sujets nécessitant une hospitalisation pendant leur séjour en urgence ; – Les sujets avec des épisodes de vomissements et le nombre d’épisodes dans les 3 groupes de traitement pendant le séjour en urgence et pendant la période de suivi de 48 heures ; – Le taux de réussite à la deuxième tentative d’ORT et le pourcentage de sujets nécessitant des tests de laboratoire pendant le séjour en urgence ; – Les sujets présentant des épisodes de diarrhée et le nombre d’épisodes dans les 3 groupes de traitement évalués pendant le séjour à l’urgence et pendant la période de suivi de 48 heures ; – Le pourcentage de sujets présentant des effets indésirables pendant le séjour en urgence et pendant la période de suivi de 48 heures. Principes de l’étude : L’analyse étant la deuxième et dernière analyse intermédiaire de l’étude, le dégré de signification a été fixé à 0,014 et les intervalles de confiance sont à 98,6%. Les variables qualitatives sont décrites avec leurs fréquences et pourcentages de niveau (pourcentages en colonne). Les variables quantitatives sont décrites avec leurs moyennes, leurs écarts-types, et leurs quartiles. Les analyses ont été effectuées à l’aide de régressions logistiques. |
| Codages et variables générées suite au gel de la base de données | |
|---|---|
| Variable(s) d’origine | Variable créée |
| Child height (cm) (V10) | Taille de l’enfant (cm) (V10B) issue d’une affectation (avec V10) |
| Duration of vomiting before enrollment (hours) (V11) | Durée des vomissements avant l’inscription (heures) (V11B) issue d’une affectation (avec V11) |
| Number of episodes of vomiting in the last 24 hours (V12) | Nombre d’épisodes de vomissements au cours des dernières 24 heures (V12B) issue d’une affectation (avec V12) |
| Number of episodes of vomiting in the last 6 hours (V13) | Nombre d’épisodes de vomissements au cours des 6 dernières heures (V13B) issue d’une affectation (avec V13) |
| Presence of diarrhea (V14) :
– 0 : No – 1 : Yes | Présence de diarrhée (V14B) issue d’une affectation (avec V14) :
– 0 : Non – 1 : Oui |
| Drugs taken at home (V15) :
– 0 : No – 1 : Yes | Médicaments pris à la maison (V15B) issue d’une affectation (avec V15) :
– 0 : Non – 1 : Oui |
| Dehydration score (V16) | Score de déshydratation (V16B) issue d’une affectation (avec V16) |
| Requiring intravenous rehydration (V17) :
– 0 : No – 1 : Yes | Réhydratation intraveineuse (V17B) issue d’une affectation (avec V17) :
– 0 : Non – 1 : Oui |
| Observation stay in ED >6 hours (V18) :
– 0 : No – 1 : Yes | Séjour d’observation à l’urgence > 6 heures (V18B) issue d’une affectation (avec V18) :
– 0 : Non – 1 : Oui |
| Requiring hospital admission (V19) :
– 0 : No – 1 : Yes | Hospitalisation (V19B) issue d’une affectation (avec V19) :
– 0 : Non – 1 : Oui |
| Presence of vomiting during ED stay (V20) :
– 0 : No – 1 : Yes | Présence de vomissements pendant le SU (V20B) issue d’une affectation (avec V20) :
– 0 : Non – 1 : Oui |
| Number of episodes of vomiting during ED stay (V21) | Nombre d’épisodes de vomissements pendant le SU (V21B) issue d’une affectation (avec V21) |
| Success at second ORT attempt (V22) :
– 0 : No – 1 : Yes | Succès à la deuxième tentative ORT (V22B) issue d’une affectation (avec V22) :
– 0 : Non – 1 : Oui |
| Requiring laboratory tests (V23) :
– 0 : No – 1 : Yes | Tests de laboratoire (V23B) issue d’une affectation (avec V23) :
– 0 : Non – 1 : Oui |
| Presence of diarrhea during ED stay (V24) :
– 0 : No – 1 : Yes | Présence de diarrhée pendant le SU (V24B) issue d’une affectation (avec V24) :
– 0 : Non – 1 : Oui |
| Number of episodes of diarrhea during ED stay (V25) | Nombre d’épisodes de diarrhée pendant le SU (V25B) issue d’une affectation (avec V25) |
| Readmitted to ED after discharge (V27) :
– 0 : No – 1 : Yes | Réadmission à l’urgence après la sortie (V27B) issue d’une affectation (avec V27) :
– 0 : Non – 1 : Oui |
| Episodes of vomiting during 48 h f-up (V28) :
– 0 : No – 1 : Yes | Épisodes de vomissements au cours des 48h de suivi (V28B) issue d’une affectation (avec V28) :
– 0 : Non – 1 : Oui |
| Number of episodes of vomiting in the last 24 hours of f-up (V29) | Nombre d’épisodes de vomissements au cours des 24h de suivi (V29B) issue d’une affectation (avec V29) |
| Episodes of diarrhea during 48 h f-up (V30) :
– 0 : No – 1 : Yes | Épisodes de diarrhée au cours des 48h de suivi (V30B) issue d’une affectation (avec V30) :
– 0 : Non – 1 : Oui |
| Number of episodes of diarrhea in the last 24 hours of f-up (V31) | Nombre d’épisodes de diarrhée au cours des 24h de suivi (V31B) issue d’une affectation (avec V31) |
| Group ITT (V3) :
– Domperidone – Ondansetron – Placebo | Groupe ITT (V3B) issue d’une affectation (avec V3) :
– Domperidone – Ondansetron – Placebo |
| Age (years) (V7) | Age (années) (V7B) issue d’une affectation (avec V7) |
| Sex (V8) :
– 1 : Female – 2 : Male | Sexe (V8B) issue d’une affectation (avec V8) :
– 1 : Féminin – 2 : Masculin |
| Child weight (kg) (V9) | Poids de l’enfant (kg) (V9B) issue d’une affectation (avec V9) |
| Tableau 1 : Codages |
| 1. Profil d’étude |
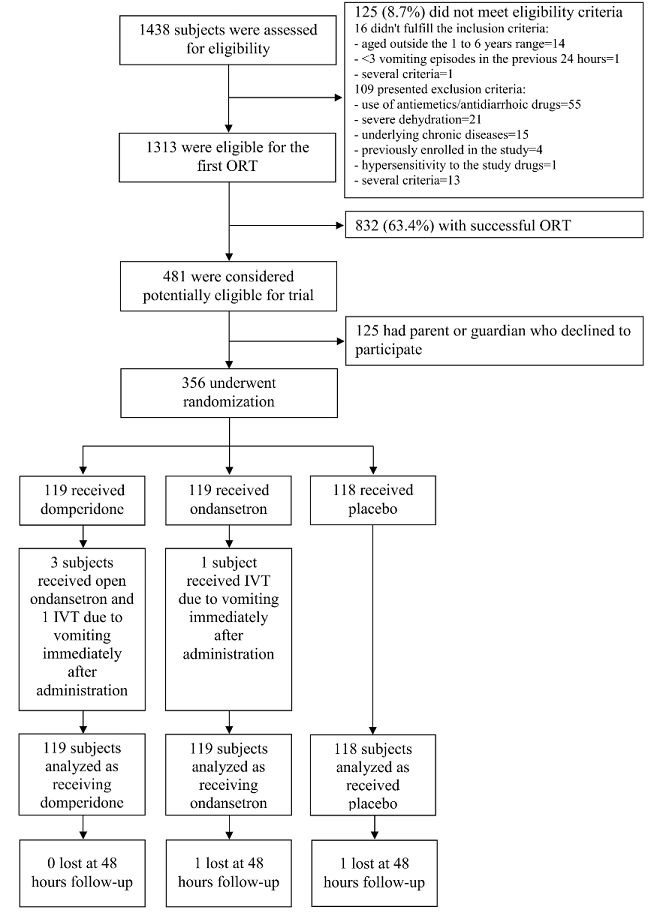
| 1.1. Flowchart |
| [Haut de page] |
| Flowchart |
| Au total, 356 enfants ont été répartis au hasard dans les groupes d’étude: 119 sous dompéridone, 119 sous ondansétron et 118 sous placebo. |
| 2. Résultats |
| 2.1. Caractéristiques de base des patients de l’étude |
| [Haut de page] |
| Les caractéristiques de base des enfants sont similaires entre groupe de randomisation. |
| Population | Groupe ITT (V3B) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| _ | domperidone | ondansetron | placebo | ||||||
| N=356 | N=119 | N=119 | N=118 | ||||||
| Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | ||||||
| Variable | n | %col | n | %col | n | %col | n | %col | |
| Age (années) (V7B) | Moyenne ±SD | 3,35 | ±1,52 | 3,36 | ±1,62 | 3,21 | ±1,4 | 3,49 | ±1,54 |
| Médiane (Q1-Q3) | 3,2 | (2-4,5) | 3,2 | (1,9-4,6) | 3,1 | (2,1-4,2) | 3,25 | (2,1-4,7) | |
| Sexe (V8B) | Féminin | 180 | 50,6 | 54 | 45,4 | 62 | 52,1 | 64 | 54,2 |
| Masculin | 176 | 49,4 | 65 | 54,6 | 57 | 47,9 | 54 | 45,8 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Poids de l’enfant (kg) (V9B) | Moyenne ±SD | 15,28 | ±4,06 | 15,06 | ±4,21 | 15,1 | ±4,05 | 15,69 | ±3,93 |
| Médiane (Q1-Q3) | 14,9 | (12-18) | 14,5 | (11,7-17,5) | 14,2 | (11,5-18,2) | 15,5 | (12,7-18,3) | |
| Taille de l’enfant (cm) (V10B) | Moyenne ±SD | 99,48 | ±15,39 | 98,09 | ±13,41 | 99,44 | ±13,89 | 100,93 | ±18,39 |
| Médiane (Q1-Q3) | 99 | (88-110) | 99 | (87-110) | 98,5 | (89-110) | 99 | (89-110) | |
| Durée des vomissements avant l’inscription (heures) (V11B) | Moyenne ±SD | 18,9 | ±20,75 | 15,71 | ±17,42 | 20,97 | ±23,02 | 20,05 | ±21,2 |
| Médiane (Q1-Q3) | 10 | (6-24) | 9 | (5-18) | 10 | (6-24) | 12 | (7-20) | |
| Nombre d’épisodes de vomissements au cours des dernières 24 heures (V12B) | Moyenne ±SD | 8,47 | ±4,38 | 8,37 | ±3,94 | 8,37 | ±4,46 | 8,69 | ±4,74 |
| Médiane (Q1-Q3) | 8 | (5,25-10) | 8 | (6-10) | 7 | (5-10) | 8 | (6-10) | |
| Nombre d’épisodes de vomissements au cours des 6 dernières heures (V13B) | Moyenne ±SD | 5,68 | ±3,53 | 5,92 | ±3,31 | 5,65 | ±3,77 | 5,46 | ±3,52 |
| Médiane (Q1-Q3) | 5 | (3-7) | 6 | (4-7) | 5 | (3-7) | 5 | (3-7) | |
| Présence de diarrhée (V14B) | Oui | 147 | 41,3 | 47 | 39,5 | 51 | 42,9 | 49 | 41,5 |
| Non | 209 | 58,7 | 72 | 60,5 | 68 | 57,1 | 69 | 58,5 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Médicaments pris à la maison (V15B) | Oui | 57 | 16 | 21 | 17,6 | 19 | 16 | 17 | 14,4 |
| Non | 299 | 84 | 98 | 82,4 | 100 | 84 | 100 | 85,6 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Score de déshydratation (V16B) | Moyenne ±SD | 8 | ±1,58 | 7,94 | ±1,62 | 8,02 | ±1,52 | 8,03 | ±1,62 |
| Médiane (Q1-Q3) | 8 | (7-9) | 8 | (7-9) | 8 | (7-9) | 8 | (7-9) | |
| Tableau 2 : Résultats – Caractéristiques de base des patients de l’étude – Tri croisé |
| # Taille de l’enfant (cm) (V10B) : 79 données non disponibles, 25 individus dont l’item « Groupe ITT (V3B) » est renseigné « domperidone », 29 individus dont l’item « Groupe ITT (V3B) » est renseigné « ondansetron » et 25 individus dont l’item « Groupe ITT (V3B) » est renseigné « placebo » |
| 2.2. Mesure des critères de jugement pendant le séjour à l’urgence |
| [Haut de page] |
| D’après l’analyse, l’ondansétron réduit significativement le nombre de :
– Sujets recevant une réhydratation nasogastrique ou intraveineuse par rapport à la dompéridone (OR 0,396, IC à 98,6% 0,166 à 0,945) et au placebo (OR 0,33, IC à 98,6% 0,284 à 0,383) ; – Sujets nécessitant un séjour d’observation de plus de 6 heures pour la même maladie par rapport à la dompéridone (OR 0,448, IC à 98,6% 0,206 à 0,971) et placebo (OR 0,4, IC à 98,6% 0,373 à 0,448) ; – Sujets présentant des épisodes de vomissements au cours de leur séjour en urgence par rapport à la dompéridone (OR 0,252, IC à 98,6% 0,118 à 0,535) et au placebo (OR 0,285, IC à 98,6% 0,254 à 0,317) ; – Episodes de vomissements pendant les séjours en urgence par rapport au placebo (OR 0,5, IC à 98,6% 0,298 à 0,84) ; – Sujets sans succès à la deuxième tentative d’ORT par rapport à la dompéridone (OR 0,213, IC à 98,6% 0,088 à 0,517) et au placebo (OR 0,203, IC à 98,6% 0,164 à 0,252) ; – Sujets nécessitant des tests de laboratoire par rapport au placebo (OR 0,351, IC à 98,6% 0,314 à 0,394). |
| Population | Groupe ITT (V3B) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| _ | domperidone | ondansetron | placebo | ||||||
| N=356 | N=119 | N=119 | N=118 | ||||||
| Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | ||||||
| Variable | n | %col | n | %col | n | %col | n | %col | |
| Réhydratation intraveineuse (V17B) | Oui | 78 | 21,9 | 30 | 25,2 | 14 | 11,8 | 34 | 28,8 |
| Non | 278 | 78,1 | 89 | 74,8 | 105 | 88,2 | 84 | 71,2 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Séjour d’observation à l’urgence > 6 heures (V18B) | Oui | 96 | 27 | 37 | 31,1 | 20 | 16,8 | 39 | 33,1 |
| Non | 260 | 73 | 82 | 68,9 | 99 | 83,2 | 79 | 66,9 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Hospitalisation (V19B) | Oui | 46 | 12,9 | 16 | 13,4 | 10 | 8,4 | 20 | 16,9 |
| Non | 310 | 87,1 | 103 | 86,6 | 109 | 91,6 | 98 | 83,1 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Présence de vomissements pendant le SU (V20B) | Oui | 122 | 34,3 | 53 | 44,5 | 20 | 16,8 | 49 | 41,5 |
| Non | 234 | 65,7 | 66 | 55,5 | 99 | 83,2 | 69 | 58,5 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Nombre d’épisodes de vomissements pendant le SU (V21B)
N=122 | Moyenne ±SD | 2,13 | ±1,7 | 2,23 | ±1,8 | 1,4 | ±0,68 | 2,33 | ±1,82 |
| Médiane (Q1-Q3) | 2 | (1-3) | 2 | (1-3) | 1 | (1-2) | 2 | (1-3) | |
| Succès à la deuxième tentative ORT (V22B) | Oui | 261 | 73,3 | 78 | 65,5 | 107 | 89,9 | 76 | 64,4 |
| Non | 95 | 26,7 | 41 | 34,5 | 12 | 10,1 | 42 | 35,6 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Tests de laboratoire (V23B) | Oui | 85 | 24,1 | 31 | 26,1 | 17 | 14,3 | 37 | 32,2 |
| Non | 268 | 75,9 | 88 | 73,9 | 102 | 85,7 | 78 | 67,8 | |
| Total | 353 | 100 | 119 | 33,7 | 119 | 33,7 | 115 | 32,6 | |
| Présence de diarrhée pendant le SU (V24B) | Oui | 79 | 22,2 | 26 | 21,8 | 33 | 27,7 | 20 | 16,9 |
| Non | 277 | 77,8 | 93 | 78,2 | 86 | 72,3 | 98 | 83,1 | |
| Total | 356 | 100 | 119 | 33,4 | 119 | 33,4 | 118 | 33,1 | |
| Nombre d’épisodes de diarrhée pendant le SU (V25B)
N=79 | Moyenne ±SD | 2,42 | ±2,22 | 1,88 | ±1,88 | 3,09 | ±2,45 | 2 | ±2,03 |
| Médiane (Q1-Q3) | 2 | (1-2) | 1 | (1-2) | 2 | (2-4) | 1,5 | (1-2) | |
| Tableau 3 : Résultats – Mesure des critères de jugement pendant le séjour à l’urgence – Tri croisé |
| # Tests de laboratoire (V23B) : 3 données non disponibles, 3 individus dont l’item « Groupe ITT (V3B) » est renseigné « placebo » |
| Groupe ITT (V3B) | |||
|---|---|---|---|
| ondansetron | placebo | ||
| N=119 | N=118 | ||
| Variable | OR*[IC98.6%] | OR*[IC98.6%] | |
| Réhydratation intraveineuse (V17B) | Oui | 0,396[0,166 ; 0,945] | 1,201[0,584 ; 2,467] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Séjour d’observation à l’urgence > 6 heures (V18B) | Oui | 0,448[0,206 ; 0,971] | 1,094[0,552 ; 2,169] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Hospitalisation (V19B) | Oui | 0,591[0,207 ; 1,682] | 1,314[0,537 ; 3,213] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Présence de vomissements pendant le SU (V20B) | Oui | 0,252[0,118 ; 0,535] | 0,884[0,464 ; 1,686] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Nombre d’épisodes de vomissements pendant le SU (V21B)
N=122 | Ref – domperidone
0,516[0,234 ; 1,138] | Ref – domperidone
1,032[0,785 ; 1,355] | |
| Succès à la deuxième tentative ORT (V22B) | Oui | – Ref – domperidone | – Ref – domperidone |
| Non | 0,213[0,088 ; 0,517] | 1,051[0,538 ; 2,053] | |
| Tests de laboratoire (V23B) | Oui | 0,473[0,208 ; 1,078] | 1,347[0,662 ; 2,739] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Présence de diarrhée pendant le SU (V24B) | Oui | 1,372[0,654 ; 2,882] | 0,730[0,324 ; 1,645] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Nombre d’épisodes de diarrhée pendant le SU (V25B)
N=79 | Ref – domperidone
1,332[0,899 ; 1,974] | Ref – domperidone
1,053[0,647 ; 1,713] | |
| *OR : Odds Ratio | |||
| Tableau 4 : Résultats – Mesure des critères de jugement pendant le séjour à l’urgence – Forces d’association |
| 2.3. Mesure des critères de jugement lors du suivi téléphonique |
| [Haut de page] |
| Aucune différence significative n’est observée entre les trois groupes et les sujets réadmis à l’urgence pour la même maladie, les sujets avec des épisodes de vomissements et de diarrhée au cours des 48 heures de suivi et le nombre d’épisodes de vomissements et de diarrhée au cours des 24 dernières heures de suivi. |
| Population | Groupe ITT (V3B) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| _ | domperidone | ondansetron | placebo | ||||||
| N=356 | N=119 | N=119 | N=118 | ||||||
| Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | Moy±SD
Méd(Q1Q3) ou | ||||||
| Variable | n | %col | n | %col | n | %col | n | %col | |
| Réadmission à l’urgence après la sortie (V27B) | Oui | 36 | 10,2 | 12 | 10,1 | 11 | 9,3 | 13 | 11,1 |
| Non | 318 | 89,8 | 107 | 89,9 | 107 | 90,7 | 104 | 88,9 | |
| Total | 354 | 100 | 119 | 33,6 | 118 | 33,3 | 117 | 33,1 | |
| Épisodes de vomissements au cours des 48h de suivi (V28B) | Oui | 104 | 29,4 | 27 | 22,7 | 36 | 30,5 | 41 | 35 |
| Non | 250 | 70,6 | 92 | 77,3 | 82 | 69,5 | 76 | 65 | |
| Total | 354 | 100 | 119 | 33,6 | 118 | 33,3 | 117 | 33,1 | |
| Nombre d’épisodes de vomissements au cours des 24h de suivi (V29B)
N=104 | Moyenne ±SD | 2,38 | ±1,91 | 2,54 | ±2,08 | 2,25 | ±1,71 | 2,37 | ±1,97 |
| Médiane (Q1-Q3) | 2 | (1-3) | 2 | (1-3) | 1 | (1-3) | 1,5 | (1-3) | |
| Épisodes de diarrhée au cours des 48h de suivi (V30B) | Oui | 144 | 40,7 | 51 | 42,9 | 49 | 41,5 | 44 | 37,6 |
| Non | 210 | 59,3 | 68 | 57,1 | 69 | 58,5 | 73 | 62,4 | |
| Total | 354 | 100 | 119 | 33,6 | 118 | 33,3 | 117 | 33,1 | |
| Nombre d’épisodes de diarrhée au cours des 24h de suivi (V31B)
N=144 | Moyenne ±SD | 4,44 | ±6,3 | 3,93 | ±3,95 | 4,82 | ±7,77 | 4,66 | ±6,93 |
| Médiane (Q1-Q3) | 3 | (2-4) | 3 | (2-4) | 3 | (2-4) | 3 | (1-5) | |
| Tableau 5 : Résultats – Mesure des critères de jugement lors du suivi téléphonique – Tri croisé |
| # Réadmission à l’urgence après la sortie (V27B) : 2 données non disponibles, 1 individu dont l’item « Groupe ITT (V3B) » est renseigné « ondansetron » et 1 individu dont l’item « Groupe ITT (V3B) » est renseigné « placebo » |
| # Épisodes de vomissements au cours des 48h de suivi (V28B) : 2 données non disponibles, 1 individu dont l’item « Groupe ITT (V3B) » est renseigné « ondansetron » et 1 individu dont l’item « Groupe ITT (V3B) » est renseigné « placebo » |
| # Nombre d’épisodes de vomissements au cours des 24h de suivi (V29B) : 13 données non disponibles, 6 individus dont l’item « Groupe ITT (V3B) » est renseigné « ondansetron » et 7 individus dont l’item « Groupe ITT (V3B) » est renseigné « placebo » |
| # Épisodes de diarrhée au cours des 48h de suivi (V30B) : 2 données non disponibles, 1 individu dont l’item « Groupe ITT (V3B) » est renseigné « ondansetron » et 1 individu dont l’item « Groupe ITT (V3B) » est renseigné « placebo » |
| # Nombre d’épisodes de diarrhée au cours des 24h de suivi (V31B) : 6 données non disponibles, 3 individus dont l’item « Groupe ITT (V3B) » est renseigné « ondansetron » et 3 individus dont l’item « Groupe ITT (V3B) » est renseigné « placebo » |
| Groupe ITT (V3B) | |||
|---|---|---|---|
| ondansetron | placebo | ||
| N=119 | N=118 | ||
| Variable | OR*[IC98.6%] | OR*[IC98.6%] | |
| Réadmission à l’urgence après la sortie (V27B) | Oui | 0,917[0,312 ; 2,697] | 1,115[0,394 ; 3,154] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Épisodes de vomissements au cours des 48h de suivi (V28B) | Oui | 1,496[0,722 ; 3,099] | 1,838[0,896 ; 3,770] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Nombre d’épisodes de vomissements au cours des 24h de suivi (V29B)
N=104 | Ref – domperidone
0,923[0,653 ; 1,305] | Ref – domperidone
0,957[0,692 ; 1,322] | |
| Épisodes de diarrhée au cours des 48h de suivi (V30B) | Oui | 0,947[0,496 ; 1,807] | 0,804[0,418 ; 1,545] |
| Non | – Ref – domperidone | – Ref – domperidone | |
| Nombre d’épisodes de diarrhée au cours des 24h de suivi (V31B)
N=144 | Ref – domperidone
1,025[0,940 ; 1,119] | Ref – domperidone
1,022[0,933 ; 1,119] | |
| *OR : Odds Ratio | |||
| Tableau 6 : Résultats – Mesure des critères de jugement lors du suivi téléphonique – Forces d’association |
| Tables et figures |
| Tableau 1 : Codages |
| Tableau 2 : Résultats – Caractéristiques de base des patients de l’étude – Tri croisé |
| Tableau 3 : Résultats – Mesure des critères de jugement pendant le séjour à l’urgence – Tri croisé |
| Tableau 4 : Résultats – Mesure des critères de jugement pendant le séjour à l’urgence – Forces d’association |
| Tableau 5 : Résultats – Mesure des critères de jugement lors du suivi téléphonique – Tri croisé |
| Tableau 6 : Résultats – Mesure des critères de jugement lors du suivi téléphonique – Forces d’association |
| Figure 1 : Profil d’étude – Flowchart – Flowchart |
| Date de réalisation : 13 avril 2021 |
| Réalisateur : RUS |
| Logiciel version 0.1 |